- Accueil
- qu'est-ce qu'une période ?
qu'est-ce qu'une période ?
Qu’est-ce qu’une période ?
Une période est une ligne de la Classification Période des Eléments. Mais en soit, une période c'est pas grand chose seul et il vaut mieux parler des couches électroniques voire, pour être plus précis, des orbitales atomiques.
Cependant, ce n'est pas un concept facile à comprendre. Plongeons nous dans les périodes de façon graduelle.?
1. Une période, comme ensemble de couches électroniques
Pour les atomes les plus légers (les 3 ou 4 premières périodes, lignes de la Classification Périodique des Eléments), une construction de couches électroniques est possible. Ces couches, que l'on nomme K, L, M, ..., sont des "lignes" où les électrons peuvent demeurer.
Représentation des couches électroniques K, L, M et leur capacité d'accueil d'électrons. (Provient de Univers, Cosmologie et Physique)
Néanmoins, les électrons ne font pas ce qu'ils veulent et ne peuvent pas tous aller se loger dans la couche K. Comme à l'hôtel, les couches électroniques ont un nombre limité de places. Par exemple, la couche K ne peut acceuillir que 2 électrons, la couche L 8 et la couche M 18. Ce phénomène de limitation du nombre d'électrons par couche est la brique fondamentale de la physique quantique : c'est la quantification des niveaux d'énergies.
Mais alors, comment les électrons se répartissent-ils dans ces couches électroniques ?
En suivant la règle du "premier arrivé, premier servi" !! En effet, pour l'atome d'Hydrogène ayant qu'un seul électron, il va se loger dans la couche K, la première. Pour l'Hélium, possédant 2 électrons, le deux électrons s'en vont remplir intégralement la couche K. Pour le Lithium, 3 électrons. 2 vont dans la couche K et le troisième électron se sentant repoussé, va aller se réfugier dans la couche L. Et ainsi de suite jusqu'à remplir successivement les couches L et M.
Pour chaque atome, on peut décrire leur structure électronique, c'est-à-dire la répartition des électrons dans les couches.
Ainsi, pour l'Hydrogène, la structure électronique est : (K)1. Pour l'Hélium, c'est (K)2, le Lithium (K)2(L)1 ... Par exemple, pour l'Aluminium (Z=13, donc 13 électrons), la structure électronique est : (K)2(L)8(M)3.
Malheureusement, ce n'est pas une répartition juste et permettant d'expliquer pleins de comportements électroniques d'atomes. Et donc nous devons plonger dans les ténèbres de la structure atomique et dans le monde quantique. ATTACHEZ VOS CEINTURES, CA RISQUE DE SECOUER !!!
2. Vers le monde des orbitales atomiques
Dans ce monde, c'est la physique quantique qui domine !! Je pense que je vous doit quelques explications !
Les électrons ne sont pas totalement libres de leur mouvement et ne peuvent pas dormir n'importe où. De plus, ils ne peuvent pas avoir n'importe quelle énergie par le principe de la quantification de l'énergie.
De plus, dans l'espace tridimensionnel des atomes (je le rappelle petit de l'ordre de 10-10 mètres !!), il n'existe pas de "lignes" ou couches électroniques clairement définies !!
Imaginez, c'est comme si la limite entre votre jardin et celui de votre voisin n'était pas bien définie, était floue, qu'il existait une zone, admettons un mètre de chaque côté, où c'est à la fois chez vous et chez votre voisin !! (A ce point, vous devez normalement vous tapez la tête contre les murs ^^ Et ce n'est que le début !!)
Par contre, ces lignes existent bien, mais nous devons prendre en compte de cet aspect "flou", "aléotoire", probabiliste. On va alors les appeler ORBITALES ATOMIQUES.
Une orbitale atomique, c'est comme une zone de l'espace où il y a une certainte probabilité de trouver un électron, comme la zone floue de 2 mètres de large entre chez vous et chez votre voisin. (Pour les plus tordus d'entre vous, la VRAIE définition d'une orbitale atomique, c'est une fonction mathématique donnant la probabilité de présence d'un électron d'un atome dans un espace donné. C'est une fonction d'onde.)
Et, grâce à des calculs mathématiques dont je vous épargne les détails (pour ne pas vous perdre, j'aime votre présence :D !!), on peut les représenter comme des nuages de probabilités de présence autour du noyau atomique.
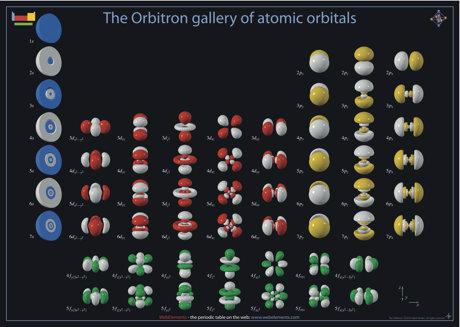
Représentation des orbitales atomiques. (Provient de The Orbitron)
C'est super joli, beau, ... mais le champ des possibles avec ces orbitales est immense !! On va commencer par les décrire !
Il existe 4 grandes familles d'orbitales atomiques :
- Les orbitales du bloc s (s pour sharp) : ce sont les orbitales atomiques les "plus simples". Schématiquement, ce sont de grosses boules (en bleu sur l'image au-dessus, première colonne).
- Les orbitales du bloc p (p pour principal) : ce sont deux lobes l'un à côté de l'autre schématiquement (en jaune sur l'image au-dessus, trois dernières colonnes).
- Les ortibales du bloc d (d pour diffuse) : On commence à être dans des formes assez bizarres et complexe à décrire (en rouge sur l'image au-dessus, deuxième à sixième colonne).
- Les orbitales du bloc f (f pour fine, ou fundamental) : Encore plus complexe à décrire (en vert, les deux dernières lignes sur l'image au-dessus).
Chaque période (oui on revient à la définition tout en début ^^) a un numéro associé : c'est le nombre quantique principal, noté n. C'est un nombre naturel non nul ( positif et n=1 ; 2 ; 3 ; 4 ; ...).
Chaque bloc possède des orbitales atomiques. Ces orbitales ne peuvent accueillir qu'un nombre limité d'électrons (comme les couches K, L, M) défini via un second nombre quantique : le nombre quantique secondaire (ou azimutal), noté l. Ce nombre est aussi un entier et ne peut pas excéder la valeur n-1 (donc entre 0 et n-1).
Chaque bloc a un nombre quantique secondaire l précis : 0 pour le bloc s, 1 pour le bloc p, 2 pour le bloc d, et 3 pour le bloc f.
Le nombre limite d'électron par orbitale atomique est donné par la valeur de l via la formule : nombre d'électrons = 2*(2*l+1) . Ainsi, une orbitale atomique du bloc s peut accueillir jusqu'à 2 électrons, une du bloc p peut en contenir 6 électrons, puis une du bloc d peut en contenir 10 et 14 électrons pour le bloc f.
Comment nomme-t'on les orbitales atomiques ?
Les orbitales atomiques (ou OA pour les intimes, surtout pour les flemmards comme moi ^^) se nomme de la façon suivante :
- Le premier caractère est un numéro et correspond à la valeur du nombre quantique principal n (de 1 à 7 souvent) et donc correspond au numéro de la période.
- Le second caractère est la lettre du bloc auquelle elle appartient (s, p, d ou f).
Ainsi, il existe l'OA 1s, 2s, 2p, 3s, 3p, 3d, ... ATTENTION : l'orbitale 2d n'existe pas car le bloc d, c'est l=2 et n=2 ici. Or l ne peut pas être égal à n (toujours inférieur ou égal à n-1).
Une autre règle de la physique quantique dit qu'il ne peut pas y avoir plus de 2 électrons dans la même OA. C'est le principe d'exclusion de Pauli.
Mais, si vous avez bien suivi (et j'en suis persuadé ;) ), j'ai dit que une OA du bloc p, d ou f peut contenir respectivement 6, 10 ou 14 électrons. C'est parce qu'en réalité, il existe plusieurs types d'OA de ces blocs.
Par exemple, il existe trois OA différentes qui se nomment 2p. On les nomme 2px, 2py et 2pz. Chacune pouvant accueillir 2 électrons, 2*3=6, le compte est bon !! Il en est de même avec toutes les OA du bloc p : elles ont toutes le nom de npx, npy et npz. Pour le bloc d, il en existe 5 différentes (je ne les nomme pas tout de suite, leur nom est peu important et un peu compliqué). Pour le bloc f, il en existe 7 différentes.
D'ailleurs, toutes les orbitales npx correspond à la dernière colonne de l'image plus haut, les orbitales npy correspond à la 1ère colonne jaune, et les npz la seconde colonne jaune.
Avec ces orbitales atomiques, on peut construire la structure électronique des atomes, la vraie ! Mais je vous laisse regarder la règle de Klechkowski pour savoir comment faire ;) (parce que c'est pas une chose facile, sauf si vous êtes très précautionneux, comme il faut l'être en chimie !!)
Date de dernière mise à jour : 06/04/2020
Ajouter un commentaire